|
Ю.А. Александров
Основы радиационной экологии
Учебное пособие. – Йошкар-Ола: Мар. гос. ун-т, 2007. – 268 с.
Раздел 3. Биологическое действие ионизирующих излучений
3.4. Молекулярные повреждения, возникающие в клетках
В результате
процессов, происходящих на первичных стадиях действия излучений, изменения
могут возникнуть в любых молекулярных структурах, входящих в состав живой
клетки.
К
наиболее биологически значимым повреждениям должны быть отнесены в первую
очередь нарушения структуры ДНК. Прежде всего, это повреждения оснований,
выщепление отдельных оснований из цепи, разрушение фосфоэфирных связей, лежащее
в основе одиночных и двойных разрывов цепочек ДНК, распад дезоксирибозы,
повреждения ДНК-мембранного комплекса, разрушение водородных связей, нарушение
связей ДНК-белок, повышающее атакуемость ДНК вторичными радикалами и
ферментами, сшивки ДНК-ДНК и ДНК-белок.
Аналогичные
радиационно-химические изменения наблюдаются и в облученной РНК. Разница
состоит лишь в том, что в РНК, в связи с ее однонитчатой структурой, не может
быть двунитевых разрывов.
Не менее значимыми для
жизнедеятельности клетки являются и вызванные прямым или непрямым действием
радиации повреждения белка. В белковых молекулах участками, в которых чаще
всего реализуется поглощенная энергия, являются тиоловые и дисульфидные
группировки, а также аминокислоты, содержащие спаренные циклы (триптофан,
фенилаланин, тирозин). В результате, хотя все аминокислоты поглощают энергию
облучения с равной вероятностью, в конце физико-химической стадии некоторые из
них оказываются избирательно пораженными.
При смертельных уровнях
облучения (6-10 Гр) инактивация белков и ферментов незначительна и не
обнаруживается сразу после облучения. Образующиеся в присутствии кислорода и
воды свободные радикалы могут приводить к разрыву пептидной связи, образованию
амида, кетокислоты и гидропе-рекисного радикала. Все это приводит к нарушению
структуры белка: разрыву дисульфидных мостиков, водородных связей, пептидной
цепи, образованию сшивок между пептидными цепями, отщеплению аммиака,
сероводорода, окислению сульфгидрильных групп и ароматических аминокислот, к
конформационным изменениям вторичной и третичной структуры белка.
В
частности, возникают реакции окисления белковых SH-групп, которые нередко протекают по цепному механизму с
образованием дисульфидов:
R–SH + НО*
-> R–S* + Н2О;
R–SH + 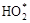 -> R–S* + Н2О2; -> R–S* + Н2О2;
R–S*
+ R–SH -> R–S–S–R + Н*.
Кроме
того, дисульфиды могут образовываться путем рекомбинации появляющихся при
облучении радикалов R–S*:
2R–S* -> R–S–S–R
или в результате
взаимодействия тиолов с Н2О2:
2R–SH
+ Н2О2 -> R–S–S–R + H2O.
Радиационно-химические
повреждения структуры белка могут возникать и в результате реакций
дезаминирования:
H3N+ – СН2 – СОО–
+ НО* -> НО – СН2 – COO– + N+H2.
Радиационно-химические
изменения белков, прежде всего изменения их вторичной и третичной структуры,
могут привести к изменению биологических свойств, в том числе ферментативной
активности.
В
липидной фракции первичные изменения при воздействии ионизирующих излучений
состоят в образовании свободных радикалов, которые, взаимодействуя с
кислородом, являются источником возникновения перекисных соединений. Последние
в свою очередь могут вступать в реакцию с жирами, в результате чего образуются
гидроперекиси:
LH -> L* + Н*;
L*
+ О2 -> 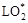 + LH -> LOOH + L*; + LH -> LOOH + L*;
L*
+ 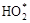 -> LOOH, -> LOOH,
где L* –
радикал липида.
Гидроперекиси
очень нестойки и при наличии ионов металлов с переменной валентностью легко
распадаются с образованием ряда высокоактивных радикалов:
LOOH -> L*+ НО2; LOOH -> LO* + НО–;
LOOH -> 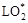 + Н*. + Н*.
Образовавшиеся
радикалы могут дать толчок к развитию цепных реакций окисления, в том числе
перекисного окисления липидов.
Перекисные соединения
разрушаются в дальнейшем с образованием оксикислот, альдегидов и других
продуктов окисления жиров. При облучении большими дозами радиации происходит
декарбоксилирование жирных кислот и даже их распад.
Важные последствия лучевых
повреждений структуры липидов проявляются в нарушении строения клеточных
мембран. Вовлечение липидов мембран в процессы перекисного окисления может
вызывать деструкцию липопротеидных комплексов, что служит причиной изменения
проницаемости мембран, смещения ионных градиентов в клетке, нарушения процессов
адсорбции и активного транспорта ряда веществ. Нарушаются также процессы
окислительного фосфорилирования, нормальное течение которых обеспечивается
упорядоченной локализацией ферментов на мембранах. Повреждение мембран лизосом
приводит к выходу и активации гидролитических ферментов.
Продукты
перекисного окисления ненасыщенных жирных кислот вследствие обнаруженных у них
радиомиметических свойств (способность вызывать разрывы цепей ДНК,
возникновение хромосомных аберраций, подавление репарации повреждений ДНК)
получили наименование первичных или липидных
радиотоксинов, и им отводится существенная роль в дальнейшем
развитии лучевого поражения клетки. К первичным радиотоксинам относят также
обнаруживаемые в облучаемых клетках хиноны и семихиноны – продукты
окисления фенолов (по Ю.Б. Кудряшову, 2001).
Изменения структуры углеводов
наблюдаются преимущественно при воздействии высоких доз ионизирующих излучений.
Они сводятся к деполимеризации и окислению полисахаридов, что приводит к
распаду углеводородной цепи и образованию кислоты формальдегида. Среди
продуктов распада углеводов могут обнаруживаться глиоксаль и гиалуроновые
кислоты. Довольно существенное значение для развития изменений в
соединительнотканных структурах имеет распад мукополисахаридов, в частности,
гиалуроновой кислоты.
По степени проявления
морфологических изменений клетки и ткани млекопитающих, т.е. по степени
возрастания радиочувствительности можно расположить в следующем порядке:
нервная ткань, хрящевая и костная ткань, мышечная ткань, соединительная ткань,
щитовидная железа, пищеварительные железы, легкие, кожа, слизистые оболочки,
половые железы, лимфоидная ткань и костный мозг.
Таблица 34 –
Радиочувствительность клеток по Д0
, Гр
|
Виды тканей
|
Д0
|
|
Лимфоидные
клетки
|
0,5
|
|
Клетки
костного мозга (кроветворные)
|
0,9-1,0
|
|
Клетки
эпителии кишечника
|
1,3
|
|
Клетки
спермиогонного эпителия
|
1,7
|
|
Эпителии
почечных канальцев
|
1,5-1,6
|
|
Эпителии
альвеол молочной железы
|
1,3
|
|
Фолликулы щитовидной железы
|
2,0
|
Примечание. Д0
– доза, при которой доля живых клеток уменьшается в сравнении с исходной
в е раз (е – основание натуральных логарифмов = 2,72).
Исходы поражения зародышевых и
соматических клеток при воздействии ионизирующей радиации различны. Когда
поражаются зародышевые клетки, возникающие мутации (генные и хромосомные) с той
или иной скоростью, зависящей от степени доминантности и от степени снижения
жизнеспособности, элиминируются (выводятся) из популяции. Но многие мутации, в
особенности рецесивные, благодаря генетическому дрейфу и эффекту
родоначальника, могут размножаться в популяции и приводить к увеличению числа
случаев врожденных уродств, аномалий обмена веществ и т.д.
Мутационные изменения в соматических
клетках могут выражаться в гибели клеток или в приобретении клеткой новых
наследственных свойств, которые проявляются процессами малигнизации,
преждевременного старения клеток и тканей, развитием новообразований.
Резюмируя вышесказанное, можно сказать,
что критической мишенью радиационного поражения клеток является ДНК, облучение
на клеточном уровне приводит к замедлению прохождения цикла деления клетки,
образованию хроматидных и хромосомных аберраций, возникновению микроядер,
гибели клеток по апоптотическому и некротическому пути в интерфазе деления и после
вступления в митоз.
Мутагенное воздействие ИИ впервые
установили отечественные ученые Г.А. Надсон и Г.С. Филиппов в 1925 г. в опытах на дрожжах. В 1927 году это открытие было подтверждено Г. Меллером на
классическом генетическом объекте – дрозофиле. ИИ способны вызывать все виды
наследственных изменений – генные, хромосомные, геномные. Эти изменения
носят дозозависимый характер и современными представлениями считается, что
любая дополнительная выше природного радиационного фона (ПРФ) доза ИИ,
независимо от величины и мощности приводит к опасности кумулятивного
генетического эффекта и способна вызвать генетические изменения, поскольку
биологическая репарация мутации невозможна (Коглл Дж., 1986).
Таким образом, прямое и косвенное действие
ионизирующего излучения на биологические молекулы приводит к тому, что в живом
организме отмечается много разных биологических эффектов, наблюдаемых после
облучения, которые представлены в таблице 35.
Таблица 35 – Типы радиологических повреждений
|
Тип биологической организации
|
Важнейшие
радиационные эффекты
|
|
Молекулярный
|
Повреждение макромолекул – ферментов,
РНК, ДНК, воздействие на обменные процессы
|
|
Субклеточный
|
Повреждение клеточных мембран,
ядер, хромосом митохондрий и лизосом, высвобождение их ферментов
|
|
Клеточный
|
Нарушения деления клеток, их
гибель и трансформация, в т.ч. злокачественная
|
|
Ткани,
органы
|
Нарушения в красном костном
мозге, желудочно-кишечном тракте, центральной нервной системе могут привести
к радиационным повреждениям и гибели, отдаленным последствиям
|
|
Организм
|
Различные виды радиационных
последствий, вплоть до
летального исхода
|
|
Популяции
|
Изменение генетических
характеристик вследствие генных, хромосомных мутаций у индивидуумов
|
|

